Resumen
Índice
- Autores
- Introducción
- 1. Efecto incretina. Fisiología. Efectos de los arGLP-1
- 2. Clasificación y posología
- 3. Eficacia clínica
- 4. Efectos extrapancreáticos
- 5. Efectos adversos. Seguridad cardiovascular
- 6. Lugar de los agonistas de los receptores GLP-1 en el tratamiento de la diabetes mellitus tipo 2
Agonistas del receptor de GLP-1 en la diabetes tipo 2
Autores
José Juan Alemán Sánchez. Especialista en Medicina Familiar y Comunitaria. Unidad de Investigación del Hospital Universitario Nuestra Señora de Candelaria. Tenerife.
Fernando Álvarez Guisasola. Especialista en Medicina Familiar y Comunitaria. CS Ribera del Órbigo. León.
Escarlata Angullo Martínez. Especialista en Medicina Familiar y Comunitaria. CS Escola Graduada. Baleares.
Sara Artola Menéndez. Especialista en Medicina Familiar y Comunitaria. CS José Marvá. Madrid.
Luis Ávila Lachica. Especialista en Medicina Familiar y Comunitaria. Consultorio de Almachar. UGC Vélez Norte. Málaga.
Joan Barrot de la Puente. Especialista en Medicina Familiar y Comunitaria. CS Jordi Nadal. Salt (Girona).
Ana M. Cebrián Cuenca. Especialista en Medicina Familiar y Comunitaria. CS San Antón. Cartagena (Murcia).
Xavier Cos Claramunt. Especialista en Medicina Familiar y Comunitaria. CAP Sant Martí. Barcelona.
Josep Franch Nadal. Especialista en Medicina Familiar y Comunitaria. CS Raval Sud. Barcelona.
Jorge Navarro Pérez. Especialista en Medicina Familiar y Comunitaria. Hospital Clínico Universitario Valencia, INCLIVA, Universidad de Valencia, CIBERESP. Valencia
Domingo Orozco Beltrán. Unidad de Investigación. CS Cabo Huertas. Departamento de Alicante-Sant Joan D’Alacant. Alicante.
Manuel Antonio Ruiz Quintero. Especialista en Medicina Familiar y Comunitaria. CS Agost. Alicante.
En nombre del Grupo de Trabajo de Diabetes de la semFYC y de la Fundación redGDPS.
Introducción
El control metabólico de la glucosa es más complejo que la exclusiva interacción entre la insulina y el glucagón. El efecto incretina (INtestinal seCRETion of INsulin) apoya la idea de que algunas sustancias segregadas a nivel intestinal favorecen la liberación de insulina tras la ingesta. Entre las hormonas denominadas incretinas destaca el péptido similar al glucagón 1 (GLP-1), que se ha mostrado fundamental en el control de la homeostasis de la glucosa a través de la regulación de la secreción de insulina dependiente de la glucosa a partir de las células beta-pancreáticas, la disminución de la concentración plasmática de glucagón y el retraso del vaciamiento gástrico. Las personas con diabetes tipo 2 (DM2) muestran una disminución de la secreción del GLP-1, y dado que los niveles circulantes de estos péptidos disminuyen rápidamente tras su liberación debido al efecto de una enzima proteolítica denominada dipeptidilpeptidasa 4 (DPP-4), se ha desarrollado una nueva familia farmacológica: los agonistas de los receptores de GLP-1 (arGLP-1), que son resistentes a la degradación por la DPP-4, que se administran por vía subcutánea.
Los arGLP-1 reproducen las acciones del GLP-1 endógeno, pero existen diferencias entre ellos en cuanto a estructura molecular y tamaño, duración de acción, farmacocinética, penetración de diversos compartimientos tisulares, intervalo de dosificación, eficacia, prevención cardiovascular y frecuencia de efectos adversos. Una clasificación generalizada es aquella que divide los arGLP-1 en: los de acción corta (exenatida, lixisenatida) y los de acción prolongada (liraglutida, exenatida LAR, albiglutida y dulaglutida). La albiglutida dejará de comercializarse en junio de 2018, y la semaglutida y la langlenatida están en fase de desarrollo.
Los arGLP-1 de acción prolongada se asocian con niveles plasmáticos de GLP-1 más estables y prolongados, inducen un mayor descenso de la glucemia basal en ayunas, mantienen una cierta reducción de la glucemia posprandial y, en consecuencia, un mayor descenso de la hemoglobina glicosilada (HbA1c). Debido a que su efecto de enlentecimiento del vaciamiento gástrico es menos pronunciado y se atenúa con el tiempo, estos fármacos se asocian con menores efectos adversos gastrointestinales. En España, el reembolso por parte del Sistema Nacional de Salud de estos medicamentos requiere un visado, cuyas condiciones son: tratamiento combinado en pacientes con mal control e índice de masa corporal (IMC) ≥ 30 kg/m2.
Los arGLP-1 constituyen uno de los grupos de fármacos antihiperglucemiantes de mayor potencia, dada su reducción de la HbA1c, sin riesgo de hipoglucemia. La potencia biológica de los arGLP-1 es 4-6 veces superior a la de los inhibidores de la DPP-4 (iDPP-4) e igualan o superan incluso al tratamiento con insulina basal, aportando la ventaja adicional de no precisar controles de glucemia capilar ni la necesidad de ajustar la dosis en base a estos valores. Los programas clínicos de los diferentes arGLP-1 suman más de 400 ensayos clínicos y 74 metanálisis que aseguran la validez de los datos de su eficacia. Puede comprobarse que en general las reducciones de la HbA1c rondan el 1% o más con liraglutida o dulaglutida, aunque un estudio publicado recientemente (SUSTAIN-7) mostró superioridad de la semaglutida respecto a la dulaglutida.
Los arGLP-1 muestran un amplio abanico de acciones extrapancreáticas que aporta un significativo valor añadido a sus efectos sobre el control del metabolismo hidrocarbonado, especialmente en lo que respecta a consecuencias sobre complicaciones microangiopáticas, reducción ponderal, protección cardiovascular, hepatoprotección, nefroprotección, neuroprotección y psoriasis. Todos los arGLP-1 presentan una reducción significativa de peso, lo que es un gran beneficio si se tiene en cuenta la comorbilidad frecuente de DM2 y la obesidad, aunque es muy variable dependiendo de la persona. Por lo que hay pacientes que mostraron una pérdida de peso de hasta 25 kg, mientras que en el 16% de los casos no se produjeron variaciones o incluso se observó una ganancia ponderal. La reducción ponderal tiene lugar predominantemente a expensas de la masa grasa total y visceral, lo que aporta un efecto muy beneficioso en el control de la DM2. El tratamiento con arGLP-1 se asocia a descensos de las cifras de presión arterial (PA), especialmente la sistólica, entre 2 y 8 mmHg. Como sucede con el peso y la HbA1c, cuanto más elevada sea la PA de inicio, mayor será su descenso. Los arGLP-1 inducen un perfil lipídico favorable, ya que reducen la concentración plasmática de triglicéridos, ácidos grasos y colesterol de lipoproteínas de baja densidad (c-LDL). Todos los arGLP-1, menos la lixisenatida, aumentan la frecuencia cardíaca, de 1 a 3 latidos por minuto.
En relación con los efectos adversos, todos los arGLP-1 presentan un perfil comparable de efectos secundarios. Los más frecuentes son los efectos gastrointestinales: náuseas (25-50%), vómitos (10-15%) y diarrea (8-15%). Suelen ser de intensidad leve-moderada y mejoran durante las primeras semanas de tratamiento. El riesgo de hipoglucemia se considera bajo, aunque se observa un mayor riesgo de esta cuando se combinan con insulina o sulfonilureas. Según la European Medicines Agency y la Food and Drug Administration, no existe una relación causal entre los fármacos incretínicos y la pancreatitis o el cáncer de páncreas. No obstante, se recomienda no iniciar estas terapias en pacientes con antecedentes de pancreatitis. En relación con la seguridad cardiovascular, suele medirse un objetivo compuesto que incluye muerte cardiovascular o ictus o cardiopatía isquémica no mortales, y se ha realizado predominantemente en pacientes en prevención secundaria cardiovascular. La lixisenatida y el exenatida LAR no mostraron diferencias significativas en la aparición del objetivo compuesto respecto a placebo. La liraglutida redujo la incidencia del objetivo compuesto en un 13% en comparación con placebo y se asoció significativamente con tasas más bajas de muerte cardiovascular, así como de mortalidad por todas las causas. La semaglutida también ha mostrado una reducción del objetivo compuesto, pero aún no está comercializada en España. Los cuatro estudios mostraron una tasa de efectos adversos graves (hipoglucemias graves, pancreatitis, cáncer), similares en los dos grupos de tratamiento (activo frente a placebo).
Algunos arGLP-1 (liraglutida, albiglutida y dulaglutida) tienen indicación en monoterapia, en pacientes para los cuales el uso de metformina no se considera apropiado debido a contraindicaciones o intolerancia, aunque las guías no los incluyen en primer escalón por su elevado coste respecto a otras alternativas. En terapia combinada (doble o triple), los arGLP-1 se recomiendan en combinación con fármacos orales si no se alcanza un control adecuado en pacientes con IMC ≥ 30 kg/m2, donde la pérdida de peso beneficiaría otras comorbilidades asociadas a la obesidad. Se aconseja mantener su indicación si el paciente presenta una reducción de al menos un 1% en la HbA1c y una pérdida de peso corporal de al menos un 3% a los 6 meses. En los pacientes con enfermedad cardiovascular en las que no se cumplan los objetivos de control glucémicos, se puede agregar un arGLP-1 con beneficio cardiovascular comprobado, para reducir el riesgo de mortalidad cardiovascular y por todas las causas. La combinación de insulina basal con un arGLP-1 se ha propuesto como una opción de tratamiento para intensificar la terapia con insulina en los pacientes DM2, mostrándose igual de eficaz que asociar una insulina prandial, pero reduciendo sus efectos adversos.
1. Efecto incretina. Fisiología. Efectos de los arGLP-1
Fernando Álvarez Guisasola y Xavier Cos Claramunt
El control metabólico de la glucosa es más complejo que la exclusiva interacción entre la insulina y el glucagón. Otras hormonas, ahora denominadas incretinas, el GLP-1 y el péptido inhibidor gástrico o péptido insulinotrópico dependiente de glucosa (glucose-dependent insulinotropic peptide; GIP) se han mostrado fundamentales en el control de la homeostasis de la glucosa.
El efecto incretina
La observación de que el efecto inducido sobre la secreción de insulina era diferente cuando se administraba glucosa oral frente a la misma cantidad de glucosa por vía parenteral acuñó el término de «efecto incretina», apoyando la idea de que algunas sustancias segregadas en los intestinos favorecían la liberación de insulina tras la ingesta. Actualmente conocemos que los péptidos intestinales que se liberan en respuesta a la ingesta son los responsables de este fenómeno. Los dos péptidos más conocidos y determinantes son el GLP-1 y el GIP, que estimulan la secreción de insulina a través de un receptor específico en la célula beta1.
El primer péptido intestinal identificado en la década de 1970 fue el GIP, que estimula la secreción de insulina a través de las células beta. Es un péptido de 42 aminoácidos, sintetizado y secretado por las células K intestinales (duodeno y yeyuno proximal) tras la ingesta de proteínas, hidratos de carbono y principalmente lípidos. Posteriormente, se identificó el GLP-1, en la década de 1980, que se sintetiza en las células L del intestino (íleon distal y colon), en las células alfa del islote pancreático y en algunas áreas neuronales, principalmente de la región hipotalámica. Actualmente se considera que las incretinas son responsables de hasta un 60% de la liberación de insulina posprandial; además, este efecto se realiza en función de la concentración de glucosa existente en cada momento.
En las personas con DM2 se observa una disminución de este efecto fisiológico y disminución de la secreción de GIP y, especialmente, de GLP-1, aunque este efecto parece ser reversible cuando se administra GLP-1 exógeno (pero no GIP), pudiendo revertir parcialmente la respuesta insulínica. Este hecho, sugiere un papel relevante del GLP-1 en la regulación de la secreción pancreática de insulina. La infusión endovenosa de GLP-1 en los pacientes con DM2 disminuye la hiperglucemia mediante el incremento de la secreción de insulina y la inhibición asociada de la liberación del glucagón. De forma característica, este efecto se atenúa al ir disminuyendo progresivamente los niveles de glucosa circulante, lo que condiciona una reducción de los niveles de insulina y una restauración de la secreción del glucagón, con lo que se aleja la posibilidad de una hipoglucemia. Los niveles circulantes de estos péptidos disminuyen rápidamente tras su liberación debido al efecto de una enzima proteolítica denominada DPP-4, lo que les confiere una vida media inferior a 2 minutos, siendo el GLP-1 el que más rápidamente se degrada2.
Entre los diferentes efectos del GLP-1 que regulan la homeostasis de la glucosa, se han incluido la secreción de insulina dependiente de la glucosa a partir de las células beta-pancreáticas, la disminución de la concentración plasmática de glucagón y el retraso del vaciamiento gástrico. El enlentecimiento del vaciado gástrico inducido por el GLP-1 ayuda a disminuir la hiperglucemia posprandial, pero también incrementa la sensación de saciedad, con una disminución subsecuente del apetito y de la ingesta. Es posible que el GLP-1 pueda, además, aumentar la sensación de saciedad por un efecto directo sobre el sistema nervioso central. Otros posibles beneficios relacionan el probable efecto de las incretinas sobre una mayor supervivencia de las células beta, aunque de momento esto solo se ha observado en estudios preclínicos, asimismo en estudios experimentales en animales se ha visto que el GLP-1 podría inhibir la apoptosis de las células beta y estimular la proliferación y diferenciación de las células beta-pancreáticas. Estos efectos se relacionan con la activación del receptor del GLP-1 (GLP-1R), que se expresa en las células beta, el riñón, el hígado, el miocardio, adipocitos, intestino e hipotálamo. Alguna evidencia sugiere además que este efecto sobre el GLP-1R podría ser cardioprotector 3.
En la figura 1 se muestran los efectos del GLP-1 en los tejidos periféricos.
|
Figura 1. Acciones del GLP-1 en los tejidos periféricos |
 |
| Adaptada de: Sociedad Española de Diabetes (SED). Tratado de diabetes mellitus. 2ª edición. Editorial Médica Panamericana; 2017. |
El GLP-1 ha servido de desarrollo de toda una familia farmacológica (los arGLP-1), mientras que el GIP no ha conducido a un desarrollo similar, probablemente porque sus efectos insulinotrópicos están alterados en las personas con DM2, a pesar de que los efectos insulinotrópicos del GIP pueden ser restaurados tras 4 semanas de normalización de la hiperglucemia con insulina en pacientes con DM2. A diferencia del GLP-1, el GIP aumenta la secreción de glucagón por las células alfa, estimula la lipogénesis, inhibe la lipólisis en los adipocitos y mejora la captación de ácidos grasos4.
En resumen, a partir de este grupo de péptidos se han desarrollado fármacos con efecto antihiperglucemiante que intentan obviar la rápida degradación de las incretinas una vez secretadas y se han desarrollado otras estrategias terapéuticas para evitar este deterioro de la respuesta a las incretinas: los arGLP-1, resistentes a la degradación por DPP-4 y los iDPP-4.
Referencias bibliográficas
-
Neumiller JJ. Incretin-Based Therapies. Med Clin North Am. 2015;99:107-29.
-
Tibaldi JM. Incorporating Incretin-Based Therapies into Clinical Practice for Patients with Type 2 Diabetes. Adv Ther. 2014;31:289-317.
-
Nauck M. Incretin therapies: highlighting common features and differences in the modes of action of glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors. Diabetes, Obesity and Metabolism. 2016;8:203-16.
-
Mulvihill EE, Drucker DJ. Pharmacology, Physiology, and Mechanisms of Action of Dipeptidyl Peptidase-4 Inhibitors. Endocrine Reviews. 2014;35:992-1019.
2. Clasificación y posología
Ana M. Cebrián Cuenca y Josep Franch Nadal
Los arGLP-1 reproducen las acciones del GLP-1 endógeno, pero existen diferencias entre ellos en cuanto a estructura molecular y tamaño, duración de acción, farmacocinética, penetración de diversos compartimientos tisulares, intervalo de dosificación, eficacia, prevención cardiovascular y frecuencia de efectos adversos. Una clasificación generalizada es aquella que divide los arGLP-1 en los de acción corta (exenatida, lixisenatida) y los de acción prolongada (liraglutida, exenatida LAR, albiglutida y dulaglutida).
Los arGLP-1 de acción corta (exenatida, lixisenatida) tienen una vida media de 2-5 horas1. Tras su administración, se producen importantes fluctuaciones en los niveles plasmáticos del GLP-1, dependiendo del momento de administración. Estas fluctuaciones se asocian con un mayor retardo en el vaciamiento gástrico y, por ello, en la comida subsiguiente a su administración, mayor reducción de la glucemia posprandial, incluso con disminución de la secreción de insulina, pero también con mayores efectos adversos gastrointestinales (náuseas)2. Por otra parte, tienen menor efecto sobre la glucemia basal en ayunas, momento en que las concentraciones del fármaco declinan en el plasma. Por todo ello, los arGLP-1 de acción corta se han propuesto como alternativa a la insulina prandial cuando el tratamiento con insulina basal no es suficiente1,3.
Los arGLP-1 de acción prolongada (liraglutida, exenatida LAR, albiglutida y dulaglutida) se asocian con niveles plasmáticos del GLP-1 más estables y prolongados. En consecuencia, inducen un mayor descenso de la glucemia basal en ayunas, aunque siguen manteniendo una cierta reducción de la glucemia posprandial y, en consecuencia, un mayor descenso de la HbA1c4. Debido a que su efecto de enlentecimiento del vaciamiento gástrico es menos pronunciado y se atenúa con el tiempo5, estos fármacos se asocian con menores efectos adversos gastrointestinales.
La tabla 1 muestra la clasificación de los arGLP-1 según su acción corta o prolongada y su posología.
|
Tabla 1. Clasificación de los agonistas del receptor de GLP-1 según duración de la acción |
|||||
|
De acción corta |
De acción prolongada |
||||
|
Dos veces al día |
Una vez al día |
Una vez a la semana |
|||
|
Exenatida |
Lixisenatida |
Liraglutida |
Exenatida LAR |
Albiglutida |
Dulaglutida |
|
Más efecto sobre glucemia posprandial, vaciado gástrico, náuseas |
Más efecto sobre glucemia basal Menor efecto sobre vaciado gástrico Mayor efecto en reducción de peso Menor tasa de náuseas |
||||
En España, para el reembolso de estos medicamentos, se requiere un visado. Las condiciones del visado son: tratamiento combinado en pacientes con mal control e IMC ≥ 30 kg/m2.
En la tabla 2 se resumen las indicaciones, la posología, el uso en insuficiencia renal y las condiciones de visado de los arGLP-1 de acción corta 6,7.
| Tabla 2. Preparados de acción corta | ||
|
|
Exenatida (2006)a |
Lixisenatida (2013)a |
|
Indicaciones en DM2 en adultos sin un control glucémico adecuado |
Combinación con: MET, SU, TZD, MET+ SU, MET + TZD, insulina basal ± MET y/o pioglitazona |
Combinación con hipoglucemiantes y/o insulina basal |
|
Posología |
5 μg/12 h, al menos 1 mes para mejorar la tolerabilidad Puede luego aumentarse a 10 μg/12 h |
Dosis inicial: 10 μg/24 h/14 d Dosis fija de mantenimiento: 20 μg a partir del día 15 |
|
Horario |
60 minutos antes de la comida |
60 minutos antes de la comida |
|
Olvido de la dosis |
Continuar con la siguiente dosis pautada |
Administrar 60 minutos antes de la siguiente comida |
|
Uso en IR No es necesario ajuste de dosis en IR leve en ninguno de ellos |
IR moderada: escalado cuidadoso de la dosis de 5 a 10 μg IR terminal o grave: no recomendado |
IR moderada: precaución IR terminal o grave: no recomendado |
|
MET: metformina; SU: sulfonilureas; TZD: tiazolidindionas; IR: insuficiencia renal. aAño de comercialización en España. |
||
En la tabla 3 se resumen las indicaciones, posología, uso en insuficiencia renal y condiciones de visado de los arGLP-1 de acción prolongada8-11.
|
Tabla 3. Preparados de acción prolongada |
||||
|
Liraglutida (2011)a |
Exenatida LAR (2013)a |
Albiglutida (2015)a |
Dulaglutida (2011)a |
|
|
Indicaciones en DM2 en adultos sin un control glucémico adecuado |
Monoterapia en pacientes en los que el uso de MET está contraindicado o existe intolerancia
En combinación con otros hipoglucemiantes incluyendo insulina |
Combinación con MET, SU, TZD, MET + SU, MET + TZD |
Monoterapia en pacientes en los que el uso de MET está contraindicado o existe intolerancia
En combinación con otros hipoglucemiantes incluyendo insulina |
Monoterapia en pacientes en los que el uso de MET está contraindicado o existe intolerancia
En combinación con otros hipoglucemiantes, incluyendo insulina |
|
Posología |
Dosis inicial: 0,6 mg/24 h al menos 1 semana, luego 1,2 mg. Puede subirse a 1,8 mg en 1 semana en algunos pacientes |
2 mg una vez por semana |
30 mg una vez por semana Se puede aumentar a 50 mg una vez por semana |
Monoterapia: 0,75 mg/semana En combinación: 1,5 mg/semana Pacientes ≥ 75 años: 0,75 mg/semana como dosis inicial |
|
Horario |
A cualquier hora del día, con o sin comidas, preferiblemente en torno a la misma hora todos los días |
A cualquier hora del día, con o sin comidas |
|
A cualquier hora del día, con o sin comidas |
|
Olvido de dosis |
|
Período mínimo entre dosis: 24 h |
|
Período mínimo entre dosis: 72 h |
|
Uso en IR No es necesario ajuste de dosis en IR leve en ninguno de ellos |
IR moderada: no hacer ajuste de dosis No recomendado con IR grave (TFG < 15 ml/min) o enfermedad renal terminal |
IR moderada: no recomendado IR terminal o grave: no recomendado |
No recomendado en IR grave (TFG < 30 ml/minuto/1,73 m2) ni en diálisis |
No recomendado con IR grave (TFG < 15 ml/min) o enfermedad renal terminal |
|
IR: insuficiencia renal; MET: metformina; SU: sulfonilureas; TFG: tasa de filtrado glomerular; TZD: tiazolidindionas; v: veces. aAño de comercialización en España. |
||||
Referencias bibliográficas
-
Meier JJ. GLP-1 receptor agonists for individualized treatment of type 2 diabetes mellitus. Nat Rev Endocrinol. 2012;8(12):728-42.
-
Meier JJ, Kemmeries G, Holst JJ, Nauck MA. Erythromycin antagonizes the deceleration of gastric emptying by glucagon-like peptide 1 and unmasks its insulinotropic effect in healthy subjects. Diabetes. 2005;54(7):2212-8.
-
Diamant M, Nauck MA, Shaginian R, Malone JK, Cleall S, Reaney M, et al. Glucagon-like peptide 1 receptor agonist or bolus insulin with optimized basal insulin in type 2 diabetes. Diabetes Care. 2014;37(10):2763-73.
-
Garber AJ. Long-acting glucagon-like peptide 1 receptor agonists: a review of their efficacy and tolerability. Diabetes Care. 2011;34(Suppl. 2):S279-84.
-
Nauck MA, Kemmeries G, Holst JJ, Meier JJ. Rapid tachyphylaxis of the glucagon-like peptide 1-induced deceleration of gastric emptying in humans. Diabetes. 2011;60:1561-5.
-
Ficha técnica de exenatida. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000698/WC500051845.pdf
-
Ficha técnica de lixixenatida. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://ec.europa.eu/health/documents/community-register/2017/20170918138688/anx_138688_es.pdf
-
Ficha técnica de liraglutida. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/001026/WC500050017.pdf
-
Ficha técnica de exenatida-LAR. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002020/WC500108241.pdf
-
Ficha técnica de albiglutida. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002735/WC500165117.pdf
-
Ficha técnica de dulaglutida. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002825/WC500179470.pdf
3. Eficacia clínica
Domingo Orozco Beltrán y Sara Artola Menéndez
Las acciones pancreáticas de los GLP-1 incluyen la estimulación de la secreción de insulina de forma dependiente a la glucosa y un efecto supresor sobre la secreción de glucagón, responsable de la producción endógena de glucosa. La breve vida media del GLP-1 nativo (menos de 2 minutos) hace impracticable su uso clínico.
Los arGLP1, gracias a diversas modificaciones estructurales, tienen una resistencia significativa al efecto de la enzima que los degrada (la DPP-4), permiten su administración subcutánea y una cobertura que varía desde unas horas a varias semanas. Constituyen uno de los fármacos antihiperglucemiantes de mayor potencia por la reducción de HbA1c, sin riesgo de hipoglucemia. La potencia biológica de los arGLP-1 es 4-6 veces superior a la de los iDPP-41,2.
Los arGLP-1 igualan o superan incluso el tratamiento con insulina basal, y aportan la ventaja adicional de no precisar controles de glucemia capilar con tiras reactivas ni ajustar la dosis en base a los valores de glucemia capilar.
Tipos de agonistas del receptor de GLP-1
Existen diferencias entre los arGLP-1 según el tiempo de acción (tabla 1).
Los de acción más corta y estructura similar al exendina-4 (formulación sintética derivada de un péptido contenido en la saliva del monstruo de Gila) son: exenatida y lixisenatida. Ambos ejercen un efecto más potente sobre la glucemia posprandial al retrasar el vaciamiento gástrico, además de favorecer la secreción de insulina e inhibir el glucagón. Se acompaña de mayor frecuencia de náuseas en las fases iniciales del tratamiento.
Los de acción más prolongada (liraglutida, exenatida semanal y dulaglutida) tienen menor efecto sobre el vaciamiento gástrico, pero son más potentes sobre la glucemia en ayunas. Los arGLP-1 de liberación prolongada se asocian a un aumento de la frecuencia cardíaca, posiblemente por estímulo simpático (o inhibición tono vagal)3.
|
Tabla 1. Tipos de fármacos agonistas del receptor de GLP-1 |
||||
|
Acción prolongada |
Acción corta |
|||
|
Una vez al día |
Una vez a la semana |
Dos veces al día |
Una vez al día |
|
|
Liraglutida (Victoza©) |
Exenatida LAR (Byetta©) |
Dulaglutida (Trulicity©) |
Exenatida (Byetta©) |
Lixisenatida (Lixumia©) |
|
Monoterapia o terapia combinada con cualquier antidiabético, incluyendo insulina Independiente del IMCa |
Terapia combinada. No indicado en monoterapia. Independiente del IMCa |
|||
|
Predomina efecto sobre glucemia basal |
Predomina efecto sobre glucemia posprandial |
|||
|
Disminuye los eventos CV |
|
|
Seguridad en los eventos CV |
|
|
IMC: índice de masa corporal; CV: cardiovascular. aLa ficha técnica permite prescribir arGLP-1 en pacientes con o sin sobrepeso u obesidad. Pero el visado de inspección en España solo autoriza a prescribirlo en pacientes con IMC > 30 kg/m2. |
||||
Eficacia y seguridad
Los programas clínicos de los diferentes arGLP-1 suman más de 400 ensayos clínicos y 74 metanálisis que avalan la validez de los datos de su eficacia.
Además del beneficio hipoglucemiante, tienen un efecto reductor de peso a diferencia de las sulfonilureas o las glitazonas, que lo incrementan.
Se dispone de seis diferentes moléculas dentro de la familia de los arGLP-1. La albiglutida dejará de comercializarse en junio de 2018, y la semaglutida y la langlenatida están en fase de desarrollo.
La dosis recomendada de exenatida LAR es de 2 mg una vez a la semana. Los pacientes que cambien de exenatida de liberación inmediata (ELI) a la de liberación prolongada pueden experimentar aumentos transitorios de la glucemia, que generalmente mejoran durante las dos primeras semanas después de haber iniciado el tratamiento. La ELI se administra en dosis de 5 μg o 10 μg en cualquier momento dentro de un período de 60 minutos antes de las dos comidas principales del día, separadas por aproximadamente 6 horas o más. No debe ser administrada después de la comida4,5.
La dosis de inicio de la lixisenatida es de 10 μg, una vez al día, durante 14 días. Posteriormente, se continúa con una dosis de mantenimiento de 20 μg/día6. La liraglutida debe iniciarse con 0,6 mg/semana e incrementarse a 1,2 mg/día en dosis única. En función de la respuesta clínica, al menos 1 semana después, es posible aumentar la dosis a 1,8 mg/día7.
La dosis habitual de dulaglutida es de 1,5 mg/semana, aunque en monoterapia y en pacientes mayores de 75 años se recomienda 0,75 mg/semana como dosis inicial8.
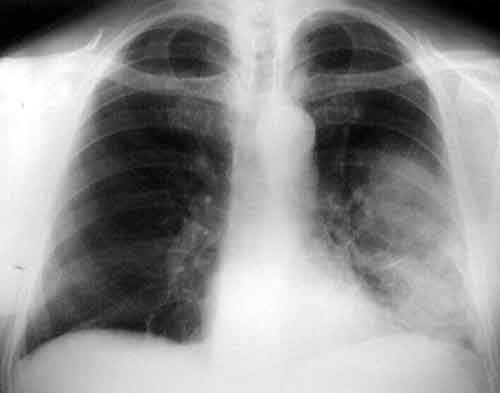
En las figuras 1 y 2 se describe la reducción de HbA1c con arGLP-1 en comparación con otros antidiabéticos. La mayoría de los estudios incluyen pacientes con HbA1c basal entre 8-8,5%. Puede comprobarse que en general las reducciones de HbA1c rondan el 1% o más con liraglutida o dulaglutida.
|
Figura 1. Acción de la liraglutida en la reducción de la hemoglobina glicosilada en comparación con otros antidiabéticos9-14 |
 |
|
Figura 2. Acción de la dulaglutida en la reducción de la hemoglobina glicosilada en comparación con otros antidiabéticos15-18 |
 |
La reducción de la HbA1c con ELI 10 μg/12 h, durante 30 semanas, fue de – 0,89%. En un estudio de 26 semanas, ELI disminuyó los valores de la HbA1c – 1,13%, mientras que la insulina glargina disminuyó los valores en – 1,10%, y la insulina aspártica bifásica en – 0,86%. En otro estudio con pacientes tratados con insulina glargina en el que se comparaba la adición de exenatida o insulina lispro, la reducción fue similar al 1% en ambos casos.
La lixisenatida 20 μg durante 24 semanas en pacientes tratados previamente con metformina alcanzó una reducción de la HbA1c de hasta un – 0-92% en comparación con placebo. Otro estudio en el que se comparó la lixisenatida antes de la comida principal o antes del desayuno durante 24 semanas obtuvo reducciones similares de HbA1c (– 0,65% frente a –0,74%). En pacientes tratados con fármacos orales más insulina glargina, la adición de lixisenatida durante 26 semanas, redujo la HbA1c un – 0,63%, en comparación con la adición de insulina glulisina una vez al día (– 0,58%) o tres veces al día (– 0,84%). Las reducciones de la glucosa plasmática en ayunas (GPA) conseguidas oscilaron entre 7,6 y 21,4 mg/dl, y en relación con la glucosa posprandial (GPP), oscilaron entre 81,2 y 143,3 mg/dl.
El estudio GRADE, cuyo diseño fue publicado en 2013, permitirá conocer en 5.000 pacientes con DM2 de menos de 5 años de duración, tratados previamente con metformina, y con HbA1c 6,8-8,5%, la eficacia comparada entre sulfonilureas, iDPP-4, arGLP-1 o insulina tras un seguimiento de 4,8 años en 37 centros sanitarios de Estados Unidos.
El estudio más reciente publicado (SUSTAIN-7)19, que compara semaglutida 0,5 mg/día y dulaglutida 0,75 mg/día en pacientes con HbA1c inicial media del 8,2%, mostró una reducción significativa de la HbA1c del 1,5% frente al 1,1%, respectivamente. Y con las dosis de semaglutida 1,0 mg y dulaglutida 1,5 mg/día, la disminución significativa de la HbA1c fue del 1,8% frente al 1,4%, respectivamente.
Referencias bibliográficas
-
Campbell JE, Drucker DJ. Pharmacology, physiology, and mechanisms of incretin hormone action. Cell Metab. 2013;17:819-37.
-
Drucker DJ. The biology of incretin hormones. Cell Metab. 2006;3:153-65.
-
Garber AJ. Long-acting glucagon-like peptide 1 receptor agonists: a review of their efficacy and tolerability. Diabetes Care 2011; 34 (Suppl. 2):S279-84.
-
Ficha técnica de exenatida. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000698/WC500051845.pdf
-
Ficha técnica de exenatida-LAR. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002020/WC500108241.pdf
-
Ficha técnica de lixixenatida. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://ec.europa.eu/health/documents/community-register/2017/20170918138688/anx_138688_es.pdf
-
Ficha técnica de liraglutida. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en:http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/001026/WC500050017.pdf
-
Ficha técnica de dulaglutida. Agencia Europea del Medicamento. [Último acceso Marzo 2018.] Accesible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002825/WC500179470.pdf
-
Bode BW, Testa MA, Magwire M, Hale PM, Hammer M, Blonde L, et al.; LEAD-3 Study Group.
-
Patient-reported outcomes following treatment with the human GLP-1 analogue liraglutide or glimepiride in monotherapy: results from a randomized controlled trial in patients with type 2 diabetes. Diabetes Obes Metab. 2010 Jul;12(7):604-12.
-
Buse JB, Sesti G, Schmidt WE, Montanya E, Chang CT, Xu Y, et al.; LiraglutideEffect Action in Diabetes-6 Study Group. Switching to once-daily liraglutide from twice-daily exenatide further improves glycemic control in patients with type 2 diabetes using oral agents. Diabetes Care. 2010 Jun;33(6):1300-3.
-
García-Hernández P, Arechavaleta-Granell Mdel R, Yamamoto J, Falahati A, González-Gálvez G; Grupo de Investigadores de LEAD-3 en México. [Liraglutide and glimepiride on glycaemic control in type 2 diabetes in the Mexican cohort (LEAD3)]. Rev Med Inst Mex Seguro Soc. 2010 Sep-Oct;48(5):543-8.
-
Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, et al.; LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016 Jul 28;375(4):311-22.
-
Rodbard HW, Buse JB, Woo V, Vilsbøll T, Langbakke IH, Kvist K, et al. Benefits of combination of insulin degludec and liraglutide are independent of baseline glycated haemoglobin level and duration of type 2 diabetes. Diabetes Obes Metab. 2016 Jan;18(1):40-8.
-
Russell-Jones D, Vaag A, Schmitz O, Sethi BK, Lalic N, Antic S, et al.; Liraglutide Effect and Action in Diabetes 5 (LEAD-5) met+SU Study Group. Liraglutide vs insulin glargine and placebo in combination with metformin and sulfonylurea therapy in type 2 diabetes mellitus (LEAD-5 met+SU): a randomised controlled trial. Diabetologia. 2009 Oct;52(10):2046-55.
-
Mearns ES, Saulsberry WJ, White CM, Kohn CG, Lemieux S, Sihabout A, et al. Efficacy and safety of antihyperglycaemic drug regimens added to metformin and sulphonylurea therapy in Type 2 diabetes: a network meta-analysis. Diabet Med. 2015 Dec;32(12):1530-40.
-
Meier JJ. GLP1 receptor agonists for individualized treatment of type 2 diabetes. Nat Rev Endocrinol. 2012;8:728-42.
-
Nathan DM, Buse JB, Kahn SE, Krause-Steinrauf H, Larkin ME, Staten M, et al.; GRADE Study Research Group. Rationale and design of the glycemia reduction approaches in diabetes: a comparative effectiveness study (GRADE). Diabetes Care. 2013 Aug;36(8):2254-61.
-
Zhang L, Zhang M, Zhang Y, Tong N. Efficacy and safety of dulaglutide in patients with type 2 diabetes: a meta-analysis and systematic review. Sci Rep. 2016 Jan 8;6:18904. doi: 10.1038/srep18904.
-
Pratley RE, Aroda VR, Lingvay I, Lúdemann J, Andreassen C, Navarria A, et al., on behalf of Sustain7 investigators. Lancet published online January 31, 2018. Doi .org/10.106/s2213-8587(18)30024-X.
4. Efectos extrapancreáticos
Jorge Navarro Pérez y Manuel Antonio Ruiz Quintero
El amplio abanico de acciones extrapancreáticas que muestran los arGLP-1 aporta un significativo valor añadido a sus efectos sobre el control del metabolismo hidrocarbonado, especialmente en lo que respecta a consecuencias sobre complicaciones microangiopáticas, reducción ponderal, protección cardiovascular, hepatoprotección, nefroprotección y neuroprotección y psoriasis1.
Estas características pueden tener una importancia clave en la individualización del tratamiento de los pacientes con DM2, e incluso encontrar aplicación en aquellos individuos sin alteraciones en el metabolismo hidrocarbonado, como el tratamiento de la obesidad.
Receptores del GLP-1 y respuesta citoprotectora
Se han identificado receptores de GLP-1 en diversos tejidos además del páncreas, como: estómago, duodeno, tronco cerebral, tálamo, hipotálamo, hipocampo, miocardio, pulmones, riñón, tejido muscular, adipocitos, músculo liso vascular, células endoteliales, monocitos, macrófagos y hepatocitos2. La presencia de receptores en estos tejidos apoya la posibilidad de activación de efectos intracelulares, además de en la célula beta, en los miocardiocitos, neuronas, etc.
Es importante recordar que en clínica la administración de arGLP-1, de acción más prolongada que el péptido nativo, induce un efecto farmacológico superior al GLP-1 nativo, y se sabe que pueden generar efectos extrapancreáticos, muchos de ellos beneficiosos para el tratamiento integral del paciente con DM2.
El término que mejor definiría la acción sobre estas células es sin duda citoprotección, especialmente en respuesta a la isquemia o a la agresión tisular mediada por tóxicos.
Evidencias experimentales obtenidas a partir de observaciones en animales
El ratón knock-out para el receptor del GLP-1 desarrolla alteraciones morfológicas miocárdicas y disfunción cardíaca, lo que sugiere un papel fisiológico del GLP-1 en el mantenimiento de la función miocárdica. También desarrolla alteraciones en la plasticidad neuronal y en la memoria, y presenta osteopenia, aumento de la actividad osteoclástica y fragilidad ósea.
Aunque aún no se dispone de evidencias en seres humanos, los modelos experimentales demuestran un efecto protector de los arGLP-1 en la disfunción cognitiva inducida por hiperglucemia o administración de lipopolisacáridos, la enfermedad de Parkinson, la enfermedad de Alzheimer, el modelo animal de corea de Hungtinton y el modelo isquémico en el que el tratamiento con exendina-4 es capaz de reducir el tamaño del infarto inducido por ligadura de la arteria cerebral media, así como de estimular la formación de células madre y neuroblastos.
En lo que respecta a la neuropatía diabética, la exendina-4 y el GLP-1 inducen el crecimiento de neuritas y mejoran la repercusión clínica de la neuropatía diabética periférica en un modelo experimental de diabetes en ratas tratadas con estreptozotocina.
Asimismo, se ha descrito un efecto de la liraglutida reductor de la albuminuria y el estrés oxidativo en ratas tratadas con estreptozotocina.
En un modelo de ratón con enfermedad pulmonar obstructiva, se relaciona el GLP-1 con un papel promotor de la síntesis de surfactante pulmonar, siendo su administración eficaz para mejorar la función respiratoria.
Efecto sobre la reducción de peso
Fisiológicamente, la secreción del GLP-1 por parte de las células L del intestino delgado posee un efecto regulador de la saciedad. En la explicación de este fenómeno se han invocado mecanismos mediados tanto a nivel central3 como periférico (inhibición de la ghrelina, enlentecimiento del vaciamiento gástrico y múltiples mecanismos adicionales)4.
Los arGLP-1 de acción corta (exenatida y lixisenatida), tienen una acción mayor de enlentecimiento gástrico. Todos los arGLP-1 presentan una reducción significativa de peso5, un gran beneficio considerando la comorbilidad frecuente de la DM2 y la obesidad.
Esta pérdida de peso es muy variable entre personas, así hay pacientes que mostraron una pérdida de peso de hasta 25 kg, mientras que en el 16% de los casos no se produjeron variaciones, o incluso se observó ganancia ponderal6.
En las evaluaciones comparativas realizadas entre distintos arGLP-1, en cuanto a la reducción ponderal, la liraglutida a dosis de 1,8 mg/día fue algo superior, pero sin significación estadística frente a la exenatida diaria, a dosis de 10 μg/12 horas en el estudio LEAD-6, y a la exenatida semanal en el estudio DURATION-6. Datos similares se obtienen con la lixisenatida, lo que sugiere que el efecto sobre el vaciamiento gástrico más intenso con la exenatida y la lixisenatida no determina la magnitud de la pérdida de peso.
Los resultados obtenidos con exenatida diaria, liraglutida, albiglutida y dulaglutida, y lixisenatida son indicativos de que la reducción ponderal tiene lugar predominantemente a expensas de la masa grasa total y visceral, lo que aporta un efecto muy beneficioso en el control de la DM2.
Adicionalmente, la reducción de peso contribuye a la mejoría de los factores de riesgo cardiovascular (FRCV) como la hipertensión, la dislipidemia o la esteatosis hepática.
En general, la pérdida de peso es de mayor magnitud cuanto más elevado es el exceso ponderal de partida. No parece que la coexistencia de náuseas o vómitos, relativamente frecuentes en las fases iniciales del tratamiento, constituya un elemento determinante en la pérdida de peso. Actualmente, la liraglutida está autorizada a dosis de 3 mg/día para el tratamiento de la obesidad, alcanzando reducciones superiores a 10 kg en 1 año, y manteniéndose el rendimiento durante 2 años7.
Efecto sobre la presión arterial
El tratamiento con los arGLP-1 se asocia a descensos de las cifras de PA, especialmente la sistólica, entre 2 y 8 mmHg5. La reducción ponderal puede desempeñar un papel en este fenómeno, sin embargo, otras acciones, como el efecto vasodilatador y estimulador de la natriuresis a través de la estimulación de la secreción de péptido natriurético auricular, visto con la liraglutida, capaz de un efecto vasodilatador al relajar el músculo liso vascular, pueden ser responsables.
Como sucede con el peso y la HbA1c, cuanto más elevada sea la PA de inicio, mayor será el descenso. La conjunción de control de la PA con HbA1c inferior al 7% y la ausencia de hipoglucemias o de ganancia ponderal son objetivos combinados importantes en los que los arGLP-1 ofrecen un rendimiento superior al resto de los tratamientos antidiabéticos disponibles (32-40% con liraglutida, 25% con exenatida, e inferiores al 15% con otros antidiabéticos), y que caracterizan su efecto integral sobre diversos elementos fisiopatológicos que contribuyen al riesgo cardiovascular aumentado en la DM2.
Efectos sobre el perfil lipídico
Los arGLP-1 inducen un perfil lipídico favorable, ya que reducen la concentración plasmática de los triglicéridos, ácidos grasos y colesterol de lipoproteínas de baja densidad (c-LDL), los efectos sobre el colesterol de lipoproteínas de alta densidad (c-HDL) son menos importantes, pero en general tienden al incremento; la variación más relevante publicada de este parámetro es un aumento del 24% tras 3 años de tratamiento con exenatida, que no se ha podido reproducir en otros estudios. Además, se ha demostrado un efecto atenuador de la hiperlipidemia posprandial en lo que respecta al grado de elevación posprandial de triglicéridos y de apolipoproteína B y lipoproteínas de muy baja densidad8. Tanto la inhibición de la síntesis de partículas lipoproteicas como la apolipoproteína B-48 y las lipoproteínas de muy baja densidad, como los efectos derivados de la mejoría en el control glucémico, la reducción ponderal y la atenuación del vaciamiento gástrico, son elementos que contribuyen al efecto sobre la dislipidemia tanto posprandial como de ayuno9. Estos factores favorecen un perfil de protección vascular.
Efectos directos de la protección miocárdica
La estimulación del receptor del GLP-1 se asocia a un efecto vasodilatador y a la protección de la isquemia miocárdica, así exenatida, liraglutida y lixisenatida son eficaces en la reducción del tamaño del infarto tras la ligadura de la arteria coronaria. El efecto se asocia también a la mejoría funcional de la capacidad contráctil del ventrículo izquierdo.
Los trabajos de Lonborg10 demostraron una reducción del 30% del tamaño inicial del infarto de miocardio en pacientes atendidos antes de 2 horas y 15 minutos desde el episodio de isquemia, mediante angioplastia y a los que se administró una perfusión de exenatida intravenosa durante 6 horas.
En pacientes con insuficiencia cardíaca, la perfusión intravenosa del GLP-1 durante 5 semanas se asocia con mejoría en la fracción de eyección ventricular, el consumo de oxígeno y la calidad de vida. Asimismo, el tratamiento con exenatida en administración intravenosa se relaciona con mejoría en el índice cardíaco, probablemente por efecto cronotrópico, y con disminución de la presión capilar pulmonar en hombres con DM2 e insuficiencia cardíaca11.
El aumento en el flujo miocárdico y la translocación de transportadores de glucosa a nivel miocárdico pueden desempeñar un papel en estos efectos. Un metanálisis12 aporta que el efecto favorecedor sobre la fracción de eyección del ventrículo izquierdo es de un 4,4%, sin que varíen las concentraciones de péptido natriurético en comparación con el placebo.
Todos los arGLP-1, menos la lixisenatida, aumentan la frecuencia cardíaca, de 1 a 3 latidos por minuto, lo que puede deberse a la activación del tono simpático o a la inhibición del sistema parasimpático, de consecuencias aún no conocidas desde el punto de vista cardiovascular.
Efecto antinflamatorio sobre la disfunción endotelial y antiaterogénica
El efecto antinflamatorio de los arGLP-1 se ha demostrado en la clínica por una reducción de radicales libres, factor de necrosis tumoral (TNF) alfa, interleucina-6, proteína amiloide A y proteína quimioatrayente de monocitos, así como de metaloproteinasa-9. Inhiben el estrés oxidativo inducido por el TNF en células endoteliales y ejercen un efecto antiapoptótico a dicho nivel; reducen las moléculas de adhesión y de otros FRCV, como el inhibidor del activador del plasminógeno-1 y el péptido natriurético tipo B, y participan en la inhibición del receptor de productos de glicosilación avanzada.
El efecto beneficioso sobre la disfunción endotelial estaría mediado por un aumento de la enzima óxido-nítrico sintetasa (eNOS) y la producción de óxido nítrico, y un efecto inhibidor sobre la expresión de la endotelina-1, de reconocido efecto vasoconstrictor.
Se ha descrito un efecto antiaterogénico, previniendo el desarrollo de lesiones arterioscleróticas o estabilizando las placas ya constituidas, al producirse una reducción de la acumulación de monocitos y macrófagos en la pared arterial y de metaloproteinasas en las placas de ateroma, además de una reducción de la formación de células espumosas, la expresión de moléculas de adhesión y la proliferación de células de músculo liso. La traducción clínica de estos efectos es evidente en la disminución significativa del grosor de la íntima-media carotídea. Esto se vio con el uso de liraglutida durante 8 meses, sin relación con la mejoría en la HbA1c y en el perfil lipídico.
Estudios muy recientes en INCLIVA, en un modelo murino que combina características del síndrome metabólico, resistencia a la insulina y aterosclerosis, causadas por una deficiencia genética parcial en el sustrato del receptor de la insulina 2 y en apolipoproteína E, demuestran un efecto ateroprotector de lixisenatida, disminuyendo la aterosclerosis y promoviendo la presencia de placas estables mediante la reprogramación del fenotipo de los macrófagos hacia un fenotipo M2, caracterizado por una mayor actividad antinflamatoria resolutoria del proceso inflamatorio13.
Efecto insulinosensibilizador y hepatoprotector
Se ha descrito un efecto insulinosensibilizador de los arGLP-1 (liraglutida), que aumenta la captación hepática y muscular de glucosa a través de los efectos antinflamatorios y los cambios inducidos en las citocinas. Asimismo, se ha observado una reducción de la grasa intrahepática, relacionada con la disminución en los factores implicados en la lipogénesis, y un efecto hepatoprotector, mediado por la inhibición del estrés oxidativo y la activación de fenómenos de autofagia.
Efectos neuroprotectores
En el sistema nervioso central hay múltiples receptores del GLP-1 (mesolímbicos e hipotalámicos) y la activación del receptor GLP-1 mesolímbico reduce el hambre, el valor hedónico de los alimentos y la motivación por los mismos. Además, no se limita a la recompensa de la ingesta de alimentos, sino que se extiende a la recompensa de la cocaína, la anfetamina y el alcohol14.
El GLP-1 y los arGLP-1 atraviesan la barrera hematoencefálica15, se ha demostrado que el GLP-1 desempeña un papel en el mantenimiento y el equilibrio de la glucosa cerebral, evitando las fluctuaciones y dando como resultado concentraciones intracerebrales de glucosa constantes. Esto se traduce en un efecto neuroprotector, al que se suma la regeneración, la proliferación y el crecimiento celular (al igual que la insulina, el GLP-1 actúa principalmente como un factor de crecimiento) y la inhibición de la apoptosis16, lo que abre posibilidades para el empleo de los arGLP-1 en el tratamiento de diferentes patologías neurológicas (enfermedad de Alzheimer, enfermedad de Parkinson). Teniendo en cuenta que las enfermedades degenerativas del sistema nervioso se encuentran presentes con frecuencia en los pacientes con diabetes, este tipo de observaciones pueden otorgar un importante valor añadido a los arGLP-1 en su prevención y tratamiento.
Efectos de protección renal
En seres humanos sanos, la infusión del GLP-1 es capaz de inhibir la reabsorción tubular de sodio, pero sin modificar de forma significativa el filtrado o el flujo renal. También se ha comprobado un efecto reductor del 19% en la concentración plasmática de angiotensina II17. Los efectos antinflamatorios del GLP-1 y sus agonistas de receptor también pueden participar en un potencial efecto protector del desarrollo de nefropatía diabética a través de la inhibición de la expansión mesangial, la albuminuria y el estrés oxidativo renal18, que son los principales factores etiopatogénicos de esta patología.
El estudio Leader con liraglutida8,19 demostró una reducción de 22% (hazard ratio [HR]: 0,84 [0,73-0,97], p = 0,02) en la incidencia o empeoramiento de la nefropatía, definida como un nuevo comienzo de macroalbuminuria, elevación al doble de los niveles previos de creatinina o necesidad de diálisis. El estudio SUSTAIN con semaglutida20 también evidenció una reducción del 36% (HR: 0,64 (0,46-0,88); p = 0,005).
Acción protectora sobre la retinopatía diabética
Con exenatida también se ha observado experimentalmente un efecto preventivo o terapéutico sobre la retinopatía diabética: un efecto antiapoptótico sobre las células retinianas y una acción protectora sobre las células ganglionares retinianas.
Otros efectos
Algunos datos sugieren un efecto osteogénico del GLP-1, posiblemente mediado por la inhibición de esclerostina. Los resultados clínicos son poco consistentes, si bien parece que el efecto de la exenatida sobre la densidad mineral ósea es más favorable que perjudicial frente al tratamiento con insulina glargina y, por otra parte, no hay datos para pensar que los arGLP-1 tengan un efecto perjudicial sobre el metabolismo óseo21.
Se han comunicado efectos beneficiosos del tratamiento con exenatida y liraglutida en pacientes con psoriasis en períodos de tratamiento de 6-10 semanas, que se asocian además a la reducción ponderal y al mejor control glucémico, así como a la disminución de la secreción de citocinas proinflamatorias. Estos hallazgos colocan a los arGLP-1 en un lugar preferente para el tratamiento de los pacientes con DM2 y psoriasis.
Referencias bibliográficas
-
Salvador J, Andrada P. Efectos extrapancreáticos de los agonistas del receptor de GLP-1: una ventana hacia nuevos objetivos del tratamiento farmacológico de la diabetes mellitus tipo 2. Med Clin (Barc). 2014;143(Supl 2):28-34
-
Ahren B. GLP-1 and extra-islet effects. Horm Metab Res. 2004;36:842-5.
-
Mietlicki-Baase EG, Ortinski PI, Rupprecht LE, Olivos DR, Alhadeff AL, Pierce RC, et al. The food intake-suppressive effects of glucagon-like peptide-1 receptor signaling in the ventral tegmental area are mediated by AMPA/kainate receptors. Am J Physiol Endocrinol Metab. 2013;305: E1367-74.
-
Umapathysivam MM, Lee MY, Jones KL, Annink CE, Cousins CE, Trahair LG, et al. Comparative effects of prolonged and intermittent stimulation of the glucagon- like peptide 1 receptor on gastric emptying and glycemia. Diabetes. 2014;63:785-90.
-
Vilsbøll T, Christensen M, Junker AE, Knop FK, Gluud LL. Effects of glucagon-like peptide-1 receptor agonists on weight loss: systematic review and meta-analyses of randomised controlled trials. BMJ. 2012;344:d7771.
-
Klonoff DC, Buse JB, Nielsen LL, Guan X, Bowlus CL, Holcombe JH, et al. Exenatide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at least 3 years. Curr Med Res Opin. 2008;24:275-86.
-
Astrup A, Carraro R, Finer N, Harper A, Kunesova M, Lean ME, et al. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes. 2012;36:843-54.
-
Bunck MC, Corner A, Eliasson B, Heine RJ, Shaginian RM, Wu Y, et al. One-year treatment with exenatide vs. insulin glargine: effects on postprandial glycemia, lipid profiles, and oxidative stress. Atherosclerosis. 2010;212:223-9.
-
Xiao C, Dash S, Lewis GF. Mechanisms of incretin effects on plasma lipids and implications for the cardiovascular system. Cardiovasc Hematol Agents Med Chem. 2012;10:289-94.
-
Lonborg J, Kelbaek H, Vejlstrup N, Botker HE, Kim WY, Holmvang L, et al. Exenatide reduces final infarct size in patients with ST-segment-elevation myocardial infraction and short-duration of ischemia. Circ Cardiovasc Interv. 2012;5:288-95.
-
Nathanson D, Ullman B, Löfström U, Hedman A, Frick M, Sjöholm A, et al. Effects of intravenous exenatide in type 2 diabetic patients with congestive heart failure: a double-blind, randomised controlled clinical trial of efficacy and safety. Diabetologia. 2012;55:926-35.
-
Munaf M, Pellicori P, Allgar V, Wong K. A meta-analysis of the therapeutic effects of glucagon-like peptide-1 agonist in heart failure. Int J Pept. 2012;249827.
-
Vinué A, Navarro J, Herrero-Cervera A, García-Cubas M, Andrés-Blasco I, Martínez-Hervás S, et al. The GLP-1 analogue lixisenatide decreases atherosclerosis in insulin-resistant mice by modulating macrophage phenotype. Diabetologia 2017 Jun 12.
-
Skibicka KP. The central GLP-1: implications for food and drug reward. Front Neurosci. 2013 Oct 14;7:181.
-
Hunter K, Hölscher C. Drugs developed to treat diabetes, liraglutide and lixisenatide, cross the blood brain barrier and enhance neurogenesis. BMC Neuroscience. 2012;13:33-8.
-
Holst JJ, Burcelin R, Nathanson E. Neuroprotective properties of GLP-1: theoretical and practical applications. Curr Med Res Opin. 2011;27:547-58.
-
Skov J, Dejgaard A, Frøkiær J, Holst JJ, Jonassen T, Rittig S, et al. Glucagon-like peptide-1 (GLP-1): effect on kidney hemodynamics and renin-angiotensinaldosterone system in healthy men. J Clin Endocrinol Metab. 2013;98: E664-71.
-
Fujita H, Morii T, Fujishima H, Sato T, Shimizu T, Hosoba M, et al. The protective roles of GLP-1R signaling in diabetic nephropathy: possible mechanism and therapeutic potential. Kidney Int. 2014;85:579-89.
-
Mann JFE, Ørsted DD, Brown-Frandsen K, Marso SP, Poulter NR, Rasmussen S, et al.; LEADER Steering Committee and Investigators. Liraglutide and Renal Outcomes in Type 2 Diabetes. N Engl J Med. 2017 Aug 31;377(9):839-48. doi: 10.1056/NEJMoa1616011.
-
Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, et al; SUSTAIN-6 Investigators. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016 Nov 10;375(19):1834-44. Epub 2016 Sep 15.
-
Mabilleau G, Mieczkowska A, Chappard D. Use of glucagon-like peptide-1 receptor agonists and bone fractures: A meta-analysis of randomized clinical trials. J Diabetes. 2014; 6:260-6.
5. Efectos adversos. Seguridad cardiovascular
Escarlata Angullo Martínez y José Juan Alemán Sánchez
Efectos adversos
En general, todos los arGLP-1 presentan un perfil comparable de efectos secundarios. Los más frecuentes son los efectos secundarios gastrointestinales: náuseas (25-50%), vómitos (10-15%) y diarrea (8-15%). Otros efectos secundarios menos frecuentes son las reacciones locales en el lugar de la inyección.
Los efectos gastrointestinales suelen ser de intensidad leve-moderada y mejoran durante las primeras semanas de tratamiento. La incidencia de las náuseas y los vómitos parece ser mayor con los arGLP-1 de acción corta (exenatida, lixisenatida), mientras que las diarreas y las reacciones locales en la zona de administración parecen ser más frecuentes con los arGLP-1 de acción prolongada (liraglutida, exenatida LAR, albiglutida y dulaglutida)1,2.
El riesgo de hipoglucemia se considera bajo con los arGLP-1 debido a sus efectos dependientes de la glucosa sobre la insulina y la secreción de glucagón. Sin embargo, se observa un mayor riesgo de hipoglucemia cuando los arGLP-1 se combinan con insulina o sulfonilureas, por lo que el ajuste de la dosis de estos fármacos debe llevarse a cabo de forma adecuada al utilizar estas combinaciones2.
Pancreatitis y riesgo de cáncer
A pesar de que tanto la Food and Drug Administration como la European Medicines Agency coinciden en señalar que el análisis de los datos disponibles en relación con la seguridad en el uso de esta familia no indica una relación causal entre los fármacos incretínicos y la pancreatitis o el cáncer de páncreas3, se siguen manteniendo las advertencias sobre el riesgo de ambas enfermedades en las fichas técnicas de los fármacos incretínicos (iDPP-4 y arGLP-1), añadiendo la recomendación de no iniciar estas terapias en pacientes con antecedentes de pancreatitis, así como de descartar pancreatitis en todo paciente en tratamiento con estos fármacos que presenten dolor abdominal.
Los estudios actuales sugieren un papel probable de la activación del receptor del péptido similar al glucagón del tipo 1 (R-GLP-1) en el desarrollo de cáncer de páncreas y cáncer de tiroides en roedores. En humanos, sin embargo, la expresión del R-GLP-1 en células pancreáticas humanas y en tejido tiroideo es menor o ausente, lo que condiciona que los hallazgos en estudios al respecto realizados en humanos sean controvertidos y no concluyentes. En estudios observacionales hechos en humanos y en el análisis de los datos de ensayos clínicos, no ha sido demostrado este posible riesgo incrementado de cáncer de páncreas4. En relación con el cáncer de células T de tiroides o los niveles elevados de calcitonina, tampoco se ha descrito ninguna asociación significativa en estudios con humanos5.
Seguridad cardiovascular
Además de su efecto hipoglucemiante, los arGLP-1 reducen FRCV como el peso, la PA sistólica (PAS) y, en menor grado, la PA diastólica (PAD), y mejoran el perfil lipídico. Los arGLP-1 parecen ser más eficientes en la reducción del peso y de la PAS, al mismo tiempo que producen un mayor y sostenido aumento de la frecuencia cardíaca, un FRCV independiente, respecto a los arGLP-1 de acción corta2,6.
El primer ensayo clínico de no inferioridad, aleatorizado y doble ciego, para evaluar los efectos cardiovasculares de un arGLP-1 (lixisenatida) frente a placebo en pacientes con DM2 fue ELIXA7.
Los pacientes reclutados tenían DM2 con un síndrome coronario agudo en los 180 días previos a su inclusión en el estudio. El objetivo primario fue evaluar los efectos sobre la morbimortalidad con una variable combinada de 4 puntos (MACE-4P): mortalidad cardiovascular (MCV), infarto de miocardio (IM) no mortal, accidente cerebrovascular (ACV) no mortal y hospitalización por angina inestable. El período de seguimiento medio fue de 25 meses. La lixisenatida no mostró diferencias significativas en la aparición de MACE-4P respecto a placebo (13,4% frente a 13,2%, HR 1,02, IC 95% 0,89-1,17) y alcanzó la no inferioridad frente a placebo (p < 0,001), aunque no consiguió la superioridad (p = 0,81). No hubo diferencias significativas entre los grupos en la tasa de hospitalización por insuficiencia cardíaca (HR 0,96; IC 95% 0,75-1,23) o tasa de mortalidad (HR 0,94; IC 95% 0,78-1,13). La lixisenatida no se asoció con una mayor tasa de eventos adversos graves o hipoglucemia grave, pancreatitis, neoplasias pancreáticas o reacciones alérgicas que el placebo.
En el ensayo de seguridad cardiovascular de liraglutida (LEADER)8, los pacientes reclutados fueron diabéticos tipo 2 con alto riesgo cardiovascular que se aleatorizaron en dos brazos: liraglutida 1,8 mg/día frente a placebo. El tiempo medio de seguimiento del estudio fue de 3, 5 años.
La variable principal MACE-3P del estudio estaba compuesta por MCV, IM no mortal y ACV no mortal. Los objetivos secundarios incluyeron un MACE ampliado con revascularización coronaria y hospitalización por angina inestable o insuficiencia cardíaca, los componentes MACE individuales, todas las causas de muerte y los resultados microvasculares.
Liraglutida redujo la incidencia del objetivo primario en un 13% en comparación con placebo (13,0% frente a 14,9%, HR 0,87, IC 95% 0,78-0,97), con una p < 0,001 para la no inferioridad y una p = 0,01 para la superioridad. Asimismo, la liraglutida se asoció significativamente con tasas más bajas de MCV (4,7% frente a 6,0%, HR 0,78, IC 95% 0,66-0,93; p = 0,007), así como de mortalidad por todas las causas (8,2% frente a 9,6%, HR 0,85, IC 95%: 0,74-0,97; p = 0,02). Las frecuencias de IAM, AVC y hospitalización por insuficiencia cardíaca fueron menores, aunque sin significación estadística, en el brazo de intervención respecto al brazo control. Los pacientes asignados al grupo de tratamiento con liraglutida no presentaron mayor incidencia de pancreatitis ni aumentos significativos de cáncer de páncreas ni carcinoma medular de tiroides.
El tercer arGLP-1 con un estudio de seguridad cardiovascular publicado es semaglutida9, un arGLP-1 de administración semanal aún no comercializado en España. Se trata de un ensayo clínico aleatorizado frente a placebo, realizado, al igual que los dos anteriores, con pacientes con DM2 con alto RCV (el 83% de los pacientes presentaban basalmente un evento CV previo o enfermedad renal crónica [ERC]). De nuevo, el objetivo primario evaluado fue una variable compuesta por MCV, IM no fatal y ACV no fatal.
El tratamiento con semaglutida mostró un 26% de menor riesgo del objetivo compuesto primario (6,6% frente a 8,9%, HR 0,74, IC 0,58-0,95; p < 0,001 para no inferioridad), a expensas de un 39% de descenso de los AVC (1,6% frente a 2,7% de placebo, HR 0,61, IC 95% 0,38-0,99; p = 0,04) y un 26% de IAM (2,9% frente a 3,9%, HR 0,74, IC 95% 0,51-1,08; p = 0,12), pero sin diferencias a nivel de MCV en ambos grupos.
Las tasas de empeoramiento de la ERC fueron más reducidas en el grupo del semaglutida (3,8 frente a 6,1%, HR 0,64, IC 95% 0,46-0,88; p = 0,005), si bien se observó un inesperado incremento de las complicaciones derivadas de la retinopatía. Se desconoce el mecanismo del empeoramiento de las complicaciones en la retinopatía diabética y no se puede descartar que se debiera a un efecto directo del fármaco. Según este estudio, y al margen de las complicaciones de la retinopatía, el semaglutida tendría un perfil de seguridad parecido al resto de arGLP-1.
El cuarto arGLP-1 con un estudio de seguridad cardiovascular publicado es la exenatida LAR. Se trata del estudio EXSCEL10, un ensayo clínico aleatorizado que incluyó 14.752 pacientes con DM2 en los que se comparó recibir 2,0 mg de exenatida LAR una vez por semana por vía subcutánea o recibir placebo durante un período de 3,2 años. El 73,3% tenían enfermedad CV establecida previa. De nuevo, el objetivo primario evaluado fue una variable compuesta por MCV, IM no fatal y ACV no fatal. El objetivo primario se manifestó de forma similar en ambos grupos (11,4% frente a 12,2% HR 0,91, IC 0,83-1,00). El resto de objetivos (muerte de causa CV, IM fatal o no fatal, AVC fatal o no fatal, IM fatal, AVC fatal, hospitalización por insuficiencia cardíaca, hospitalización por síndrome coronario agudo) también fueron similares en ambos grupos. En relación con los efectos adversos graves relacionados con el estudio, fueron parecidos en ambos grupos.
La seguridad CV del resto de componentes de este grupo farmacológico se ha evaluado en metanálisis y se ha concluido que los tratamientos con incretinas no incrementan los eventos CV6 ni la mortalidad por todas las causas11.
Referencias bibliográficas
-
Bettge K, Kahle M, Abd El Aziz MS, Meier JJ, Nauck MA. Occurrence of nausea, vomiting and diarrhoea reported as adverse events in clinical trials studying glucagon-like peptide-1 receptor agonists: A systematic analysis of published clinical trials. Diabetes Obes Metab. 2017 Mar;19(3):336-47.
-
Dalsgaard NB, Brønden A, Vilsbøll T, Knop FK. Cardiovascular safety and benefits of GLP-1 receptor agonists. Expert Opin Drug Saf.2017 Mar;16(3):351-63.
-
Egan AG, Blind E, Dunder K, De Graeff P, Hummer T, Bourcier T, et al. Pancreatic safety of incretin based drugs–FDA and EMA assessment. N Engl J Med. 2014;370(9):794-7.
-
Monami M, Nreu B, Scatena A, Cresci B, Andreozzi F, Sesti G, et al. Safety issues with glucagon-like peptide-1 receptor agonists (pancreatitis, pancreatic cancer and cholelithiasis): Data from randomized controlled trials. Diabetes Obes Metab. 2017;0:1-9. https://doi.org/10.1111/dom.12926.
-
Tseng CH, Lee KY, Tseng FH. An updated review on cancer risk associated with incretin mimetics and enhancers. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev. 2015;33(1):67-124.
-
Mannucci E, Monami M. Cardiovascular Safety of Incretin-Based Therapies in Type 2 Diabetes: Systematic Review of Integrated Analyses and Randomized Controlled Trials. Adv Ther. 2017 Jan;34(1):1-40. doi: 10.1007/s12325-016-0432-4.
-
Pfeffer MA, Claggett B, Diaz R, Dickstein K, Gerstein HC, Køber LV, et al.; ELIXA Investigators. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. N Engl J Med. 2015 Dec 3;373(23):2247-57. doi: 10.1056/NEJMoa1509225.
-
Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, et al; LEADER Steering Committee on behalf of the LEADER Trial Investigators. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016 Jul 28;375(4):311-22. doi: 10.1056/NEJMoa1603827.
-
Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, et al; SUSTAIN-6 Investigators. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016 Sep 15.
-
Holman RR, Bethel MA, Mentz RJ, Thompson VP, Lokhnygina Y, Buse JB, et al; EXSCEL Study Group. Effects of Once-Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2017 Sep 28;377(13):1228-39.
-
Jiali Liu, Ling Li, Ke Deng, Chang Xu, Jason W Busse, Per Olav Vandvik, et al. Incretin based treatments and mortality in patients with type 2 diabetes: systematic review and meta-analysis. [Internet.] 2017;357:j2499. Disponible en: https://doi.org/10.1136/bmj.j2499.
6. Lugar de los agonistas de los receptores GLP-1 en el tratamiento de la diabetes mellitus tipo 2
Luis Ávila Lachica y Joan Barrot de la Puente
Monoterapia
En general, los arGLP1 no se consideran una opción terapéutica en monoterapia por su coste, aunque la liraglutida, la albiglutida y la dulaglutida tienen indicación en monoterapia en pacientes para los cuales el uso de la metformina no se considera apropiado debido a contraindicaciones o intolerancia1.
Terapia combinada de dos fármacos
Para la biterapia se recomienda su combinación con fármacos orales. Están indicados, junto a otros antidiabéticos, si no se alcanza un control adecuado. Se ha de considerar la administración de los arGLP-1 en pacientes con IMC ≥ 30 kg/m2, donde la pérdida de peso beneficiaría otras comorbilidades asociadas a la obesidad2. Se aconseja mantener su indicación si el paciente presenta una reducción de al menos un 1% en HbA1c y una pérdida de peso corporal de al menos un 3% a los 6 meses3.
En los pacientes con enfermedad cardiovascular en los que no se cumplan los objetivos de control glucémicos, se puede agregar un arGLP-1 con beneficio cardiovascular comprobado, para reducir el riesgo de mortalidad cardiovascular y por todas las causas3.
Triple terapia
Si la doble terapia oral no es eficaz, no se tolera o está contraindicada, hay que considerar la combinación con arGLP-14. Se recomiendan los arGLP-1 en pacientes con IMC ≥ 30 kg/m2, como alternativa a la adición de insulina. Igual que en el caso anterior, se ha de mantener su indicación si el paciente presenta una reducción de al menos un 1% de la HbA1c y una pérdida de peso de al menos 3% del peso corporal a los 6 meses3.
Puede ser una asociación muy interesante desde el punto de vista fisiopatológico, y además existen estudios recientes que apoyan las ventajas de esta asociación (AWARD10), y en la ficha técnica no se contraindica la asociación a inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2).
Igual que en el apartado anterior, en los pacientes con enfermedad cardiovascular en los que no se cumplan los objetivos de control glucémicos, se puede agregar un arGLP-1 con beneficio cardiovascular comprobado, para reducir el riesgo de mortalidad cardiovascular y por todas las causas3.
Combinación con insulina
La combinación de insulina basal con un arGLP-1 se ha propuesto como una opción de tratamiento para intensificar la terapia con insulina en los pacientes con DM2, con lo que se reducen sus efectos adversos. La mayoría de los estudios muestran que la adición de un arGLP-1 a la insulina basal es tan eficaz como la adición de dosis de insulina prandial5.
Para los pacientes que no pueden lograr un control glucémico adecuado con insulina basal e hipoglucemiantes orales, la intensificación con un arGLP-1 puede ofrecer una serie de ventajas en comparación con la adición de insulina prandial de acción rápida. Las ventajas de la utilización de arGLP-1 incluyen fundamentalmente la reducción del riesgo de hipoglucemias, una mitigación/reducción del aumento de peso asociado con la terapia insulínica, disminución de las necesidades de insulina y simplificación de la complejidad de su administración. Además de los beneficios metabólicos, cardiovasculares y renales6.
Los estudios clínicos revisados están asociados a insulinas basales (insulina glargina, detemir, lispro protamina y degludec) y pacientes con enfermedad avanzada. Esta combinación de arGLP-1 e insulina basal sería de elección en personas con DM2 y limitaciones para pautas con más dosis de insulina, tales como:
-
Obesos en los que pautas con más dosis de insulina podrían incrementar el peso.
-
Personas con antecedentes de hipoglucemias o alto riesgo de sufrirlas.
-
Personas que no quieren o no pueden utilizar múltiples dosis de insulina.
-
Personas que han sufrido un evento macrovascular.
Esta alternativa de intensificación es de mayor coste que la intensificación con insulina (especialmente si se compara con insulina humana), aunque los estudios demuestran que es coste-eficiente6. En cuanto a la presentación en dosis premezcladas de insulina basal y arGLP-1 (insulina degludec y liraglutida/insulina glargina y lixisenatida), no están aún disponibles en España.
Las guías de práctica clínica y los arGLP-1
Haciendo un repaso de las principales guías de práctica clínica, encontramos que:
-
La Guía ADA aconseja los aGLP-1 a partir de terapia combinada asociada a metformina si por sus características (efecto sobre el peso, eficacia, efectos secundarios, riesgo de hipoglucemias y coste) es adecuada para el paciente, y en todos los escalones terapéuticos, hasta su asocición con insulina basal en terapia intensiva7.
-
La Guía NICE aconseja los aGLP-1 en triple terapia si los pacientes tienen un IMC > 35 kg/m2 y comorbilidades o problemas psicológicos asociados con la obesidad, o bien en pacientes con IMC < 35 kg/m2 si la insulinización tiene implicaciones ocupacionales significativas o si la pérdida de peso beneficia otras comorbilidades. Solo se continuará el tratamiento con aGLP-1 si existe una reducción de la HbA1c al menos del 1% y una pérdida de al menos un 3% del peso inicial en 6 meses3.
-
La guía canadiense los aconseja en terapia combinada en pacientes con enfermedad cardiovascular. Fue la primera en incorporar los resultados del estudio LEADER (liraglutida), recomendando los arGLP-1 junto con los inhibidores SGLT2 (empagliflozina y canagliflozina) en pacientes con diabetes mellitus y enfermedad cardiovascular establecida, como tratamiento de elección asociados a metformina en terapia combinada8.
-
La International Diabetes Federation (IDF) los recomienda en triple terapia por su elevado coste y siempre que la economía del país pueda soportarlo9.
-
La RedGDPS10 los propone en segundo escalón tras metformina, al mismo nivel que los inhibidores de SGLT2, en pacientes con IMC > 35 kg/m2.
-
La guía australiana los recomienda en terapia combinada si la metformina no se toleró o estaba contraindicada, aunque los iDPP-4 serían de elección antes, y ambos asociados a sulfunilurea y en triple terapia11.
-
La guía de tratamiento en el paciente con insuficiencia renal crónica recomienda utilizar los arGLP-1 en pacientes con filtrados glomerulares > 30 ml/min/1,73 m2 siempre como alternativa y como última elección12. Recientemente se ha aprobado el uso de liraglutida y dulaglutida con FG ≥ 15ml/min/1,73 m2.
-
La guía terapéutica del tratamiento de la DM2 en el paciente anciano los recomienda junto a la metformina en terapia combinada, aunque por su efecto hiporexígeno, efectos secundarios gastrointestinales, falta de evidencia en pacientes mayores de 75 años y por ser inyectables, no los considera como los más aconsejables en los pacientes ancianos, salvo que estos no fueran vulnerables y la disminución de la obesidad repercutiera de forma beneficiosa sobre otras comorbilidades13.
-
La guía de diabetes y obesidad avalada por ocho sociedades (Sociedad Española de Medicina Interna [SEMI], Sociedad Española de Diabetes [SED], Fundación redGDPS, Sociedad Española de Cardiología [SEC], Sociedad Española para el Estudio de la Obesidad [SEEDO], Sociedad Española de Endocrinología y Nutrición [SEEN], Sociedad Española de Médicos de Atención Primaria [SEMERGEN] y Sociedad Española de Medicina de Familia y Comunitaria [semFYC]) los recomienda en segundo escalón tras metformina en pacientes con IMC > 30 kg/m2. Según esta guía, los análisis que han utilizado modelos farmacoeconómicos muestran que los análogos del GLP-1 son coste-efectivos frente a otras intervenciones habituales en pacientes con DM214.
En resumen, las guías de práctica clínica aconsejan los aGLP-1 a partir de terapia combinada con metformina en pacientes obesos con comorbilidades que se beneficien de una pérdida ponderal, teniendo en cuenta sus efectos adversos, el inconveniente de ser inyectables y su coste.
Referencias bibliográficas
- AEMPS - Centro de Información online de Medicamentos de la AEMPS (CIMA) - Fichas técnicas. Buscador principal [Internet]. Disponible en: https://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=detalleForm
- Only continue GLP-1 mimetic therapy if the person with type 2 diabetes has had a beneficial metabolic response (a reduction of at least 11 mmol/mol [1.0%] in HbA1c and a weight loss of at least 3% of initial body weight in 6 months). [2015] | NICE. [cited 2018 Mar 22]; Disponible en: https://www.nice.org.uk/donotdo/only-continue-glp-1-mimetic-therapy-if-the-person-with-type-2-diabetes-has-had-a-beneficial-metabolic-response-a-reduction-of-at-least-11-mmol-mol-1-0-in-hba1c-and-a-weight-loss-of-at-least-3-of-initial-body-weight-in-6-months-2015
- Type 2 diabetes in adults: management | Guidance and guidelines | NICE. [cited 2017 Oct 23]; Disponible en: https://www.nice.org.uk/guidance/ng28
- Downes MJ, Bettington EK, Gunton JE, Turkstra E. Triple therapy in type 2 diabetes; a systematic review and network meta-analysis. PeerJ [Internet]. 2015 Dec 7 [cited 2018 Mar 23];3:e1461. Disponible en: https://peerj.com/articles/1461
- Maiorino MI, Chiodini P, Bellastella G, Capuano A, Esposito K, Giugliano D. Insulin and Glucagon-Like Peptide 1 Receptor Agonist Combination Therapy in Type 2 Diabetes: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Diabetes Care [Internet]. 2017 Apr 1 [cited 2018 Mar 22];40(4):614–24. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/28325801
- Goodall G, Costi M, Timlin L, Reviriego J, Sacristán JA, Smith-Palmer J, et al. Cost-effectiveness of exenatide versus insulin glargine in Spanish patients with obesity and type 2 diabetes mellitus. Endocrinol y Nutr (English Ed [Internet]. 2011 Aug 1 [cited 2018 Mar 23];58(7):331–40. Disponible en: https://www.sciencedirect.com/science/article/pii/S2173509311000092
- Introduction:Standards of Medical Care in Diabetes-2018. Diabetes Care [Internet]. 2018 Jan 1 [cited 2018 Mar 14];41(Suppl 1):S1–2. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/29222369
- Booth G, Cheng AYY. Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. Can J Diabetes [Internet]. 2013 Apr 1 [cited 2017 Nov 13];37:S4–7. Disponible en: http://linkinghub.elsevier.com/retrieve/pii/S1499267113000117
- International Diabetes Federation. Recommendations For Managing Type 2 Diabetes In Primary Care, 2017. Disponible en: www.idf.org/managing-type2-diabetes
- Algoritmo de tratamiento de la DM2, de la redGDPS [Internet]. [cited 2017 Jul 11]. Disponible en: http://redgdps.org/algoritmo-de-tratamiento-de-la-dm2-de-la-redgdps-20161003/
- The Royal Australian College of General Practitioners: 2016-2018. General Practice Management of Type 2 Diabetes 2016-18 [Internet]. [cited 2018 Mar 22]. Disponible en: https://www.diabetesaustralia.com.au/best-practice-guidelines
- Gómez-Huelgas R, Martínez-Castelao A, Artola S, Górriz JL, Menéndez E. Documento de Consenso sobre el tratamiento de la diabetes tipo 2 en el paciente con enfermedad renal crónica. Nefrol [Internet]. 2014 [cited 2018 Mar 22];34(1):34–45. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0211-69952014000100005
- Gómez-Huelgas R, Gómez Peralta F, Rodríguez Mañas L, Formiga F, Puig Domingo M, Mediavilla Bravo JJ, et al. Tratamiento de la diabetes mellitus tipo 2 en el paciente anciano. Rev Clínica Española [Internet]. 2018 Mar 1 [cited 2018 Feb 26];218(2):74–88. Disponible en: https://www.sciencedirect.com/science/article/pii/S0014256517302886?via%3Dihub
- Gómez Huelgas R, Gómez Peralta F, Carrillo Fernández L, Galve E, Casanueva FF, Puig Domingo M, et al. Hacia un manejo integral del paciente con diabetes y obesidad. Posicionamiento de la SEMI, SED, redGDPS, SEC, SEEDO, SEEN, SEMERGEN y SEMFYC. Rev Clínica Española [Internet]. 2015 Dec 1 [cited 2017 Nov 13];215(9):505–14. Disponible en: http://linkinghub.elsevier.com/retrieve/pii/S0014256515001940


